Enlace covalente
De Wikipedia, la enciclopedia libre
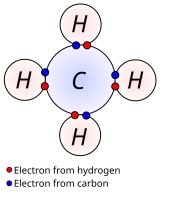
En química, las reacciones entre dos átomos no metales producen enlaces covalentes. Este tipo de enlace se produce cuando existe una electronegatividad polar, se forma cuando la diferencia de electronegatividad no es suficientemente grande como para que se efectúe transferencia de electrones, entonces los átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital denominado orbital molecular.
A diferencia de lo que pasa en un enlace iónico, en donde se produce la transferencia de electrones de un átomo a otro, en el enlace químico covalente, los electrones de enlace son compartidos por ambos átomos.
Si consideramos átomos de hidrógeno, a medida que se aproximan entre sí, se van haciendo notar las fuerzas que atraen a cada electrón al núcleo del otro átomo, hasta que dichas fuerzas de atracción se llegan a compensar con la repulsión que los electrones sienten entre sí. En ese punto, la molécula presenta la configuración más estable.
Lo que ha sucedido es que los orbitales de ambos electrones se han solapado, de modo que ahora es imposible distinguir a qué átomo pertenece cada uno de los electrones.
Sin embargo, cuando los átomos son distintos, los electrones compartidos no serán atraídos por igual, de modo que estos tenderán a aproximarse hacia el átomo más electronegativo, es decir, aquel que tenga una mayor apetencia de electrones. Este fenómeno se denomina polaridad (los átomos con mayor electronegatividad obtienen una polaridad más negativa, atrayendo los electrones compartidos hacia su núcleo), y resulta en un desplazamiento de las cargas dentro de la molécula.
Se podría decir que al átomo más electronegativo no le gusta mucho compartir sus electrones con los demás átomos, y en el caso más extremo, deseará que el electrón le sea cedido sin condiciones formándose entonces un enlace iónico, de ahí que se diga que los enlaces covalentes polares tienen, en alguna medida, carácter iónico.
Cuando la diferencia de electronegatividades es nula (dos átomos iguales), el enlace formado será covalente; para una diferencia de electronegatividades de 1,7 el carácter iónico alcanza ya el 35%, y para una diferencia de 3, será del 49.5%.
Así pues, para diferencias de electronegativades mayores de 1,7 el enlace será predominantemente de carácter iónico, como sucede entre el oxígeno o flúor con los elementos de los grupos 1 y 2; sin embargo, cuando está entre 0 y 1,7 será el carácter covalente el que predomine, como es el caso del enlace C-H.
Dependiendo de la diferencia de electronegatividad, el enlace covalente puede ser clasificado en covalente polar y covalente puro o apolar.Si la diferencia de electronegatividad está entre 0,4 y 1,7 es un enlace covalente polar, y si es inferior a 0,4 es covalente apolar.
Características del enlace covalente coordinado (Dativo)
- Formado el enlace covalente coordinado es idéntico a los demás enlaces covalentes.
- El enlace covalente coordinado se forma cuando el par electrónico compartido es puesto por el mismo átomo.
- Se representa con una flecha ” ? ” que parte del átomo que comparte la pareja de electrones SBS.
Cuando el átomo N aporta a los electrones. Este tipo de enlace se denomina enlace covalente coordinado, también conocido como enlace dativo, y se define como un enlace en el que uno de los átomos cede los dos electrones. Aunque las propiedades de enlace covalente coordinado son parecidas a las de un enlace covalente normal (dado que todos los electrones son iguales, sin importar su origen), la distinción es útil para hacer un seguimiento de los electrones de valencia y asignar cargas formales. Una base dispone de un par electrónico para compartir y un ácido acepta compartir el par electrónico para formar un enlace covalente coordinado.
[editar] Tipo de enlaces y reactividad de una sustancia
En los enlaces sigma pueden ocurrir las siguientes reacciones (Reacciones Químicas):
- Sustitución, donde un átomo es sustituido por otro. Lo reemplaza.
- Eliminación, donde un átomo se elimina de la molécula. Generalmente en esta reacción se forma un enlace pi.
Sobre los enlaces pi ocurre la adición, donde se agregan por lo general 2 átomos y se forman dos enlaces sigma. En el ejemplo se muestra la adición de un sólo átomo:
- Los enlaces sigma no polares de un átomo saturado son muy poco reactivos y para fines prácticos podemos considerarlos inertes.
- Los enlaces sigma no polares que entran a un átomo insaturado son algo más reactivos, por el efecto del enlace pi.
- Los enlaces sigma polares son reactivos.
- Los enlaces pi son reactivos
Otro tipo de reacción es la transposición, donde se redistribuyen los átomos existentes para formar un isómero de la substancia original. Esta puede ocurrir en cualquier molécula sin importar el tipo de enlace y el número de enlaces que cambian de lugar, siempre es par.