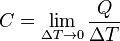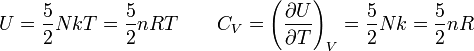Capacidad calorífica
De Wikipedia, la enciclopedia libre
La capacidad calorífica de un cuerpo es razón de la cantidad de energía calorífica transferida a un cuerpo en un proceso cualquiera por su cambio de temperatura correspondiente. En una forma menos formal es la energía necesaria para aumentar 1 K su temperatura, (usando el SI).[1] Indica la mayor o menor dificultad que presenta dicho cuerpo para experimentar cambios de temperatura bajo el suministro de calor. Puede interpretarse como una medida de inercia térmica. Es una propiedad extensiva, ya que su magnitud depende de la cantidad de material en el objeto, por ejemplo, la capacidad calorífica del agua de una piscina olímpica será mayor que la de de una cucharadita. Al ser una propiedad extensiva, la capacidad calorífica es característica de un objeto en particular, y además depende de la temperatura y posiblemente de la presión.
La capacidad calorífica no debe ser confundida con la capacidad calorífica específica o calor específico, el cual es la propiedad intensiva que se refiere a la capacidad de un cuerpo para almacenar calor,[2] y es la razón de la capacidad calorífica entre la masa del objeto. El calor específico es una propiedad característica de las sustancias y depende de las mismas variables que la capacidad calorífica.[3]
Tabla de contenidos |
[editar] Medida de la capacidad calorífica
Para medir la capacidad calorífica bajo unas determinadas condiciones es necesario comparar el calor absorbido por una sustancia (o un sistema) con el incremento de temperatura resultante. La capacidad calorífica viene dada por:
Donde:
- C es la capacidad calorífica, que en general será función de las variables de estado.
- Q es el calor absorbido por el sistema.
- ?T la variación de temperatura
Se mide en unidades del SI joules/K (o también el cal/ºC).
La capacidad calorífica (C) de un sistema físico depende de la cantidad de sustancia o masa de dicho sistema. Para un sistema formado por una sola sustancia homogénea se define además el calor específico o capacidad calorífica específica c a partir de la relación:
donde:
- c es el calor específico o capacidad calorífica específica
- m la masa de sustancia considerada
De las anteriores relaciones es fácil inferir que la masa de una sustancia, se aumenta su capacidad calorífica ya que aumenta la inercia térmica, y con ello aumenta la dificultad de la sustancia para variar su temperatura. Un ejemplo de esto se puede apreciar en las ciudades costeras donde el mar actúa como un gran termostato regulando las variaciones de temperatura.
[editar] Planteamiento formal de capacidad calorífica
Sea ? un sistema termodinámico en el estado B. Se define la capacidad calorífica Cc asociada a un proceso cuasiestático elemental c que parte de B y finaliza en el estado B‘ como el límite del cociente entre el calor Q absorbido por ? y el incremento de temperatura ?T cuando el estado B‘ tiente al inicial B.
La capacidad calorífica es, de este modo, una variable termodinámica y está perfectamente definida en cada estado de equlibrio de ?.
[editar] Capacidades caloríficas de sólidos y gases
La capacidad calorífica de los sólidos y gases depende de acuerdo con el teorema de equipartición de la energía del número de grados de libertad que tiene una molécula, como se explicará a continuación.
[editar] Gas monoatómico
Un gas monoatómico, como por ejemplo son los gases nobles tiene moléculas formadas por un sólo átomo. Eso a que la energía de rotación, al ser la molécula casi puntual, pueda despreciarse. Así en los gases monoatómicos la energía total está prácticamente toda en forma de energía cinética de traslación. Como el espacio es tridimensional y existen tres grados de libertad de tralación eso conduce de acuerdo con el teorema de equipartición a que la energía interna total U de un gas ideal monoatómico y su capacidad calorífica CV vengan dadas por:
Donde T es la temperatura absoluta, N es el número de moléculas de gas dentro del sistema que estudiamos, n el número de moles, k la constante de Boltzmann y R la constante universal de los gases ideales. Así el calor específico molar de un gas ideal monoatómico es simplemente cv = 3R/2 o cp = 5R/2. Los gases monoatómicos reales también cumplen las anteriores igualdades aunque de modo aproximado.
[editar] Gas diatómico
En un gas diatómico la energía total puede encontrarse en forma de energía cinética de traslación y también en forma de energía cinética de rotación, eso hace que los gases diatómicos puedan almacenar más energía a una temperatura dada. A temperatura próximas a la temperatura ambiente la energía interna y la capacidad caloríficas vienen dadas por:
Para temperaturas extremadamente altas, la energía de vibración de los enlaces empieza a ser importante y los gases diatómicos se desvían algo de las anteriores condiciones. A temperaturas aún más altas la contribución del movimiento término de los electrones produce desviaciones adicionales. Sin embargo, todos los gases reales como el hidrógeno (H2), el oxígeno (O2), el nitrógeno (N2) o el monóxido de carbono (CO), cumplen a temperaturas ambiente moderadas las anteriores relaciones. Por tanto estos gases tienen calores específicos o capacidades caloríficas molares cercanos a cv = 3R/2.
[editar] Gases poliatómicos
El teorema de equipartición para gases poliatómicos sugiere que los gases poliatómicos que tienen enlaces “blandos” o flexibles y que vibran con facilidad con q frecuencias, deberían tener una capacidad calorífica molar dada por:
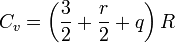 |
(*) |
Donde r mide los grados de libertad rotacionales (r = 1 para moléculas lineales, r = 2 para moléculas planas y r = 3 para moléculas tridimensionales). Sin embargo estas predicciones no se cumplen a temperatura ambiente. La capacidad calorífica molar aumenta moderadamente a medida que aumenta la temperatura. Eso se debe a efectos cuánticos que hacen que los modos de vibración estén cuantizados y sólo estén accesibles a medida que aumenta la temperatura, y la expresión (*) sólo puede ser un límite a muy altas temperaturas. Sin embargo, antes de llegar a temperaturas donde esa expresión sea un límite razonable muchas moléculas se rompen por efecto de la temperatura, no llegando nunca al anterior límite. Un tratamiento rigurso de la capacidad calorífica requiere por tanto el uso de la mecánica cuántica, en particular de la mecánica estadística de tipo cuántico.
[editar] Sólidos cristalinos
Es un hecho experimental conocido que los sólidos cristalinos no metálicos a temperatura ambiente tienen una capacidad calorífica cv más o menos constante e igual a 3R (mientras que la capacidad calorífica a presión constante sigue aumentado). Esta constatación empírica lleva el nombre de Regla de Dulong y Petit, aunque la regla de Dulong y Petit encaja con las predicciones del teorema de equipartición a bajas temperaturas esta regla falla estrepitosamente. De hecho para sólidos y líquidos a bajas temperaturas, y en algunos casos a temperatura ambiente, la expresión (*) dada por el teorema de equipartición de la energía da aún peores resultados que para los gases poliatómicos complicados. Así es necesario abandonar la mecánica estadística clásica y estudiar el problema desde el punto de vista cuántico.
Einstein fue el primero que propuso una teoría que predecía razonablemente la evolución de la capacidad calorífica de los sólidos en un rango amplio de temperaturas, que era cualitativamente correcta. Más tarde Debye propuso una mejora que hacía a la teoría cuantitativamente correcta, y ulteriormente esta teoría fue mejorada por Blackman y otros. La teoría de Einstein predice que la capacidad calorífica molar de un sólido debe variar de acuerdo con la expresión:
 |
Donde ?E es un parámetro propio de cada sólido llamado temperatura característica de Einstein del sólido. Esta ecuación predecía el comportamiento correcto a altas temperaturas:
 |
La corrección de Debye tenía en cuenta además de los efectos cuánticos que la distribución de frecuencias de los diversos modos de vibración (Einstein había supuesto para simplificar que todas las moléculas estaban vibrando alrededor de la misma frecuencia fundamental) con esa innovación, Deby llegó a la expresión algo más complicada:
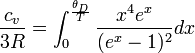 |
Esta expresión coincide con la de Einstein y la regla de Dulong y Petit a altas temperaturas y a bajas temperatura explica el comportamiento proporcional T3 observado:
 |
Esta última expresión se llama ley T3 de Debye.
[editar] Calor específico y capacidad calorífica de algunos materiales
| Material |
Densidad |
Capacidad calorífica |
|
|
kcal/kg ºC |
kg/m³ |
kcal/m³ ºC |
|
| Agua | 1 | 1000 | 1000 |
| Acero | 0,12 | 7850 | 950 |
| Tierra seca | 0,44 | 1500 | 660 |
| Granito | 0,2 | 2645 | 529 |
| Madera de roble | 0,57 | 750 | 430 |
| Ladrillo | 0,20 | 2000 | 400 |
| Madera de pino | 0,6 | 640 | 384 |
| Piedra arenisca | 0,17 | 2200 | 374 |
| Hormigón | 0,16 | 2300 | 350 |
| Mortero de yeso | 0,2 | 1440 | 288 |
| Tejido de lana | 0,32 | 111 | 35 |
| Poliestireno expandido | 0,4 | 25 | 10 |
| Poliuretano expandido | 0,38 | 24 | 9 |
| Fibra de vidrio | 0,19 | 15 | 2,8 |
| Aire | 0,24 | 1,2 | 0,29 |
En la tabla se puede ver que de los materiales comunes poseen una gran capacidad calorífica el agua muros de agua, la tierra o suelo seco compactado (adobe, tapia), y piedras densas como el granito junto a los metales como el acero. Estos se encuentran entre los 500 y 1000 kcal/m³ ºC.
Luego se encuentra otro grupo que va de 300 a 500 kcal/m³ ºC entre los que se ubica la mayoría de los materiales usuales en la construcción actual, como el ladrillo, el hormigón, las maderas, los tableros de yeso roca y las piedras areniscas.
En un último grupo se encuentra (3 a 35 kcal/m³ ºC), los aislantes térmicos de masa como la lana de vidrio, las lanas minerales, el poliestireno expandido y el poliuretano expandido que por su “baja densidad” debido a que contienen mucho aire poseen una capacidad calorífica muy baja pero sirven como aislantes térmicos.
Un caso especial es el aire (0,29 kcal/m³.ºC; 0,34 W/m³ ºC), que sirve como un medio para transportar el calor en los sistemas pasivos pero no para almacenar calor en su interior.
[editar] Véase también
[editar] Referencias