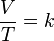Ley de Charles y Gay-Lussac
De Wikipedia, la enciclopedia libre
La ley de Charles y Gay-Lussac, frecuentemente llamada ley de Charles o ley de Gay-Lussac, es una de las leyes de los gases ideales. Relaciona el volumen y la temperatura de una cierta cantidad de gas ideal, mantenido a una presión constante, mediante una constante de proporcionalidad directa. En esta ley, Charles dice que a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura el volumen del gas disminuye. Esto se debe a que “temperatura” significa movimiento de las partículas. Así que, a mayor movimiento de las partículas (temperatura), mayor volumen del gas.
La ley fue publicada primero por Louis Joseph Gay-Lussac en 1802, pero hacía referencia al trabajo no publicado de Jacques Charles, de alrededor de 1787, lo que condujo a que la ley sea usualmente atribuida a Charles. La relación había sido anticipada anteriormente en los trabajos de Guillaume Amontons en 1702.
La ley de Charles es una de las más importantes leyes acerca del comportamiento de los gases, y ha sido usada de muchas formas diferentes, desde globos de aire caliente hasta acuarios. Se expresa por la fórmula:
Además se obtiene despejada que:
P1= T1/T2 * P2
T1= V1/V2 * T2
P2= T2/T1 * P1
T2= V2/V1 * T1
donde:
- V es el volumen
- T es la temperatura absoluta (es decir, medida en Kelvin)
- k es la constante de proporcionalidad
Siendo la presion constante,la temperatura aumenta y el volumen también.
Siendo el volumen constante,la presión aumenta y la temperatura también.
Para más información y ejemplos véase[1]
[editar] Véase también
| El contenido de esta página es un esbozo sobre física. Ampliándolo ayudarás a mejorar Wikipedia. Puedes ayudarte con las wikipedias en otras lenguas. |